作者简介:赵寿经(1961-),男,教授,博士生导师.研究方向:农业生物资源保护与利用.E-mail:swgc@jlu.edu.cn
通过RNA干扰技术(RNA interference,RNAi)调控人参发根中环阿乔醇合成酶(CS)的表达,实现了在分子水平上对人参皂苷合成途径进行调控,并获得了人参总皂苷含量提高82.17%的可遗传人参发根系。同时,证明了RNAi可成功调控植物次生代谢产物。
The RNA interference (RNAi) technology is used to regulate the expression of cycloartenol synthase in P. ginseng hairy root. The ginsenoside was regulated successfully at the molecular level. The heritable ginseng hairy roots, whose total ginsenoside content was increased by 82.17%, were obtained. Meanwhile, the study results show that RNAi can be successfully applied to production regulation of plant secondary metabolites.
人参皂苷是人参的主要活性成分,研究表明其具有良好的药用价值,随着人们生活质量的提高,需求量也大大增加[ 1]。人参皂苷生物合成的前体物质2,3-氧化角鲨烯,分别流向固醇和人参皂苷两条支路,而环阿乔醇合成酶(Cycloartenol synthase,CS)和达玛烯二醇合成酶(Dammarenediol synthase,DS)分别是这两条支路上的关键酶,在这两种酶的作用下分别生成环阿乔醇和达玛烯二醇,达玛烯二醇进一步合成达玛烷型人参皂苷[ 2],达玛烷型皂苷主要包括Rg1、Re、Rb1等多种单体皂苷[ 3]。
研究表明,反义抑制环阿乔醇合成酶基因能够使人参发根系的固醇合成水平降低,使人参皂苷合成水平提高[ 4]。本研究采用RNA干扰技术(RNA interference,RNAi)[ 5]抑制环阿乔醇合成酶基因的表达,在分子水平上调控2,3-氧化角鲨烯的代谢途径,从根本上提高人参皂苷的产量。
MS液体培养基室温摇床上培养21 d的CS-RNAi人参发根,本实验室于2011年5月份构建并保存[ 6];达玛烯二醇标准品、环阿乔醇标准品购于ChromaDex(US);人参皂苷Rg1、Re、Rb1标准品购于中国药品生物制品检验所;氯仿、甲醇、甲醛、乙腈、香草醛等试剂购于北京鼎国生物技术有限责任公司。
1.2.1 人参发根中环阿乔醇和达玛烯二醇的提取及含量测定[ 4]
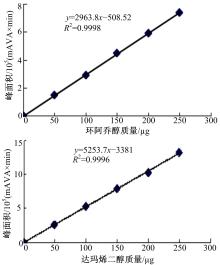
采用色谱甲醇溶解环阿乔醇和达玛烯二醇标准品,并配成1 mg/ml的标准品溶液,将两种标准品溶液分别稀释至不同浓度,采用高效液相色谱法(HPLC)分别对其含量进行检测,并以标准品质量为横坐标(μg),峰面积(mAu×min)为纵坐标分别绘制标准曲线。
取MS液体培养基培养21 d的人参发根,经蒸馏水洗净后,液氮冷冻研磨成粉末,分别加入装有5 ml乙酸酐(用于提取环阿乔醇)和5 ml色谱甲醇(用于提取达玛烯二醇)的离心管中,经超声提取,离心,取上清液,并经旋转蒸发获得浓缩物,分别以少量乙酸酐和色谱甲醇溶解并定容至1 ml。采用薄层层析(TLC)法分别对其分离,展开剂为氯仿∶甲醇=30∶1,在365 nm紫外灯下显色,并刮取相应半点,分别用300 μl乙腈溶解,过膜,经HPLC法计算环阿乔醇和达玛烯二醇的含量。
1.2.2 人参发根中总固醇的提取及含量测定[ 7]
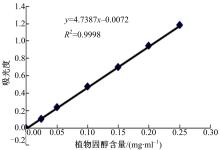
采用以乙酸酐法对人参发根的总固醇含量进行分析。以不同浓度的植物总固醇标准品在650 nm处的吸光度 A为横坐标,不同浓度的植物总固醇标准品含量(mg/ml)为纵坐标绘制标准曲线。
准确称取2 g人参发根粉末加入装有5 ml乙酸酐的离心管中,经超声提取(40 ℃,40 kHz,45 min),过滤,经旋转蒸发得到浓缩物,用少量乙酸酐溶解并定容至1 ml,以浓硫酸为显色剂,使用紫外分光光度计在650 nm处测定吸光度,每个样品测定重复3次,取平均值作为试验结果。
1.2.3 人参发根总皂苷的提取及含量测定[ 8]
(1)人参发根中总皂苷的提取
准确称取人参发根粉末1.0 g,以70%乙醇为溶剂提取(料∶液=1∶10),于摇床(25 ℃,100 r/min)浸提24 h,经超声波提取30 min(40 kHz,40 ℃),提取液经旋转蒸发得到浓缩物,以色谱甲醇为溶剂溶解并定容至10 ml,过膜备用。
(2)Re标准曲线的绘制
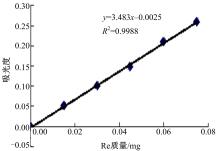
以5%香草醛-高氯酸比色法测定人参总皂苷含量[ 8],分别准确量取Re标准品溶液(1 mg/ml)0.015、0.030、0.045、0.060、0.075、0.090 mL,加到10 ml具塞试管中。水浴挥发掉溶剂后,分别向6个试管中加入5%香草醛-冰醋酸0.2 ml,高氯酸0.8 ml,振荡混匀。60 ℃水浴加热15 min,取出迅速冰浴10 min,各试管分别加入5 ml冰醋酸,摇匀。随行试剂空白,在紫外分光光度计544 nm波长处测定吸光度 A,以吸光度 A为纵坐标,质量(mg)为横坐标绘制标准曲线,并进行回归分析。
(3)人参发根总皂苷含量的测定
以5%香草醛-高氯酸比色法测定人参总皂苷含量。向待测试样中加入5 ml冰醋酸,摇匀后用紫外分光光度计在波长544 nm测定样品吸光度。每个试样重复测定3次取平均值为试验结果。
1.2.4 人参发根中3种单体皂苷(Rg1、Re、Rb1)含量的测定
采用HPLC法对人参发根中3种单体皂苷(Rg1、Re、Rb1)含量进行检测[ 9],HPLC检测条件如下,色谱柱:C18 ODS;流动相:乙腈(A)和0.05%磷酸水溶液(B);流速:0.8 ml/min;检测波长:203 nm;柱温:40 ℃;进样量:10 μl;采用梯度洗脱,试样含量采用峰面积归一法定量。
采用HPLC法分别检测环阿乔醇和达玛烯二醇的含量,其标准曲线如 图1所示,并利用该标准曲线计算待测试样的含量,结果如 表1所示。
由 表1可知,在CS-RNAi转化的人参发根中,环阿乔醇被极显著地抑制,含量仅为5.1367±1.3757 μg/g,证明本试验成功干扰了人参中CS基因的表达;CS-RNAi转化的人参发根中,达玛烯二醇含量显著高于对照组中达玛烯二醇的含量,达到124.5278±11.3319 μg/g,含量提升了20.98%,CS基因的RNA干扰促进了人参发根中达玛烯二醇的生物合成。
| 表1 人参发根中环阿乔醇和达玛烯二醇含量 Table 1 Content of cycloartenol and dammarenediol in ginseng hairy roots |
采用以乙酸酐法对人参发根的总固醇含量进行分析。以不同浓度的植物总固醇标准品在650 nm处的吸光度 A为纵坐标,不同浓度的植物总固醇标准品含量(mg/ml)为横坐标绘制标准曲线。植物总固醇的标准曲线和回归方程如 图2所示。利用该标准曲线分别计算CS-RNAi组和对照组人参发根中总植物固醇的含量,对照组和CS-RNAi组干扰发根中总植物固醇含量分别为247.30±0.24、117.54±0.39 mg/g。
CS基因的RNA干扰对人参发根中总植物固醇含量有较大影响。在CS-RNAi组中,总植物固醇含量有明显的下降,抑制率为52.47%,结果表明,环阿乔醇合成酶是人参中植物固醇合成途径中的关键酶。
采用以5%香草醛-高氯酸比色法对人参发根的总皂苷含量进行分析。其标准曲线和回归方程如 图3所示,利用该标准曲线分别计算CS-RNAi组和对照组人参发根的总皂苷的含量。
对照组的总皂苷含量仅为16.32±0.27 mg/g;在CS-RNAi组中,总皂苷含量有显著提高,为29.73±0.08 mg/g,增长了82.17%。该结果表明,CS基因的RNA干扰对人参总皂苷含量的提高有极显著的促进作用,这对调节人参发根中人参总皂苷的合成有着重大的积极作用,即通过对环阿乔醇合成酶的抑制,使2,3-氧化角鲨烯代谢流更多地流向人参皂苷合成途径,进一步促进人参皂苷的生物合成。
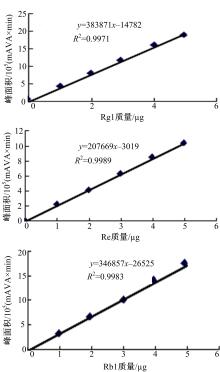
采用HPLC法分别检测CS基因RNA干扰的人参发根和对照组人参发根中Rg1、Re和Rb1的含量。其中单体皂苷Rg1、Re和Rb1标准曲线和回归方程如 图4所示。利用相应标准曲线分别计算CS-RNAi组和对照组人参发根中单体皂苷Rg1、Re和Rb1的含量,结果如 图4所示。
由 图4可知,与对照组中单体皂苷Rg1、Re、Rb1的含量结果相比,CS-RNAi干扰组即CAS基因RNA干扰转化的人参发根系中单体皂苷Rg1、Re、Rb1的含量均有显著提高,其中Rg1的含量为3.652257±0.03757 mg/g,比对照组2.349816±0.137219提高了55.43%;Re的含量为1.986733±0.12374 mg/g,比对照组1.437783±0.431815提高了38.18%;Rb1的含量为0.997865±0.173247 mg/g,比对照组0.825536±0.601130提高了20.87%。该结果表明,实现了促进人参中单体皂苷合成的正向调节;同时,本研究结果表明了RNA干扰技术运用于对植物次生代谢调节的可行性。
利用RNA干扰技术使环阿乔醇合成酶基因沉默,证明了RNA干扰技术运用于调节人参皂苷生物合成途径的可行性。实现了对环阿乔醇合成酶基因功能的鉴定,证实了人参中环阿乔醇合成酶可以催化2,3-氧化角鲨烯合成环阿乔醇,并最终生成植物固醇。对2,3-氧化角鲨烯代谢流中的人参皂苷合成途径和植物固醇合成途径进行调控,获得了高产人参皂苷的人参发根系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|