作者简介:马云海(1970-)男,教授.研究方向:仿生材料及生物材料.E-mail:myh@jlu.edu.cn
以硝酸钙和2-膦酸丁烷-1,2,4-三羧酸(PBTC)为原料通过化学合成前驱体,然后脱水缩合再高温烧结的方法制备β相磷酸三钙(β-TCP)粉体,以该粉体为基体、硬脂酸为致孔剂、PVA为粘结剂,通过模压成型的方法制取胚体烧结制备β-TCP多孔生物陶瓷。通过X射线衍射分析、扫描电镜观察、EDX能谱成分分析对制备的β-TCP多孔陶瓷进行研究。对添加致孔剂质量分数分别为15%、20%、25%、30%的4组陶瓷试样进行降解试验,发现质量分数为30%的试样降解效果最好,通过扫描电镜观察和EDX分析确认表面有类羟基磷灰石物质产生。
In this study, porous β-tricalcium Phosphate (β-TCP) bioceramic is prepared by the following steps. First, calcium nitrate and 2-phosphonic acid-1,2,4-tricarboxylic acid (PBTC) are used as raw materials to synthesize the precursor; second, β-TCP power was prepared by dehydration concentration and high temperature sintering; third, β-TCP power is taken as the matrix, stearic acid as porogen and PVA as binder to prepare the moudles by press molding; finally, β-TCP bioceramic is prepared by sintering of the moudles. The compositions of the β-TCP bioceramic are analyzed using X-ray diffraction analysis, scanning electron microscopy and EDX spectroscopy. Degradation experiments are carried out using the specimens with four levels of porogen, 15%, 20%, 25% and 30% respectively. Results show that the specimen with 30% of porogen has the best degradation performance. EDX analysis and scanning electron microscopy observation confirm the generation of hydroxyapatite materials on the surface of the β-TCP bioceramic.
生物陶瓷材料植入生物体内后极为稳定, 与生物组织的亲和性良好, 特别适合作为人体硬组织(如骨和齿)的替换修补材料, 能与骨生长在一起形成化学结合。目前生物陶瓷材料应用于骨移植的研究较多, 其中对磷酸三钙基生物陶瓷材料的研究较为广泛, 这是一种暂时性的骨替代材料, 植入体内后逐渐被降解吸收, 同时新骨逐渐长入以取代植入体, 其中性能较好的是磷酸三钙和羟基磷灰石。研究表明β -磷酸三钙(以下简称β -TCP)的钙磷比为1.5, 接近于正常人体骨且其组成成分与骨质中的无机成分相似, 具有良好的生物活性和生物相容性, 在体内降解后Ca、P元素可被直接吸收形成新骨, 而多孔的β -TCP陶瓷具有大的比表面积, 利于骨细胞的增殖、分化[1]。近年来多孔β -TCP生物陶瓷一直都是国内外学者研究的热点。
β -TCP生物陶瓷材料的制备是以β -TCP粉体作为基体, 目前常用的制备β -TCP粉体的方法主要是:固相合成法和液相合成法。樊东辉等[2]利用CaHPO4· 2H2O和CaCO3在高温下的固相反应制备β -TCP粉体用于陶瓷生产, 产出率高, 但反应物难以混合均匀, 往往伴随反应物残留, 而且在高温下反应时间较长, 易导致粉体晶粒长大。液相合成使用较广泛, 徐鹏等[3]以(NH4)2HPO3和Ca(NO3)2为原料、通过氨水调节pH值, 经洗涤、干燥、灼烧后得到β -TCP粉体; 何毅等[4]以Ca(OH)2和H3PO4为原料, 采用中和反应法制得纳米级β -TCP粉体。液相合成的方法较多, 但反应过程中易产生杂质且合成工序较繁琐, 烧结后难以得到高纯度的β -TCP粉体, 应进一步优化改进。
为了获得高纯度β -TCP粉体作为多孔β -TCP生物陶瓷的基体, 本文提出了以2-膦酸丁烷-1, 2, 4三羧酸(以下简称PBTC)作为磷源和Ca(NO3)2· 4H2O作为钙源, 通过凝胶后脱水缩合、高温烧结得到纯净的β 相磷酸三钙粉体(β -TCP)的方法, 并研究了以制备的β -TCP粉体作为基体采用添加致孔剂方法制得的多孔生物陶瓷的性能。
试验中所用的硝酸钙Ca(NO3)2· 4H2O为分析纯, PBTC为含活性组分50%的溶液, 按照钙磷原子比为1.5∶ 1称量反应物, 加入去离子水溶解后在磁力搅拌器上进行反应, 反应温度控制在85 ℃左右, 在磁力棒的搅拌作用下反应3 h, 最后得到黄色胶状前驱体, 待胶状前驱体在真空干燥箱中160 ℃下烘干后放在马弗炉中进行高温烧结, 烧结温度设定为1000 ℃, 升温速度为3 ℃/min, 达到1000℃时保温6 h后随炉冷却得到β -TCP粉体。
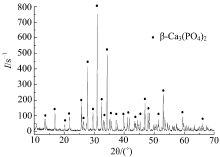
X射线衍射仪可分析确定材料的组成成分。每种晶态物质都有其特有的结构, 当X射线通过晶体物质时, 每种晶体按其化学组成和晶体结构产生固有的衍射图纹, 根据衍射峰的强度或面积, 对照已知的同种物质的标准衍射图谱可对材料的成分进行定性分析。对烧结得到的β -TCP粉体进行X射线衍射(XRD)分析, 扫描角度2θ 设定为10° ~70° , 扫描速度设定为10° /min。所得图谱如图1所示,
从图1可以看出, 制备得到的β -TCP粉体的主晶相衍射峰强度很高且十分尖锐, 可知该晶体的结晶度很好, 通过PDF卡片库对比证明此晶体即为β 相磷酸三钙(β -TCP), 未发现存在其他杂质峰。表明反应在该条件下进行得较彻底, 产物β -TCP的结晶效果良好。研究表明, β 相磷酸三钙向α 相转变的温度大约在1180 ℃, 可知实验中1000 ℃下烧结得到的β -TCP性质稳定, 得到的粉体较为纯净, 满足后续使用要求。
β -TCP粉体的粒径大小十分重要, 它对于β -TCP生物陶瓷的生物学性能及力学性能有着重要的影响。陶瓷粉体的粒径越小, 在生物体内降解效果越好, Ca、P元素被吸收重建骨骼的速度越快, 利于骨修复。同时粉体粒度越细, 表面活化能越大, 在高温烧结过程中颗粒更容易聚集形成致密陶瓷, 提高β -TCP生物陶瓷的力学性能。通常要求的陶瓷粉体的颗粒度一般小于100 μ m, 最好小于45 μ m, 不大于175 μ m。
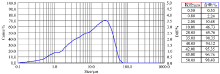
本试验应用BT-9300ST型激光粒度分布仪对烧结的β -TCP粉体颗粒进行分析, 表1和表2为分析结果。由表1可以看出, 粉体颗粒的粒径分布在0.1~72.79 μ m之间, 粒径区间从1.51~1.66 μ m开始, 区间的含量超过1%, 粒径区间为24.08~26.41 μ m时的区间含量为3.48%, 达到区间含量最大值, 区间含量呈现递增趋势, 之后递减, 在粒径区间为45.91~50.34 μ m时, 区间含量降至1.33%, 分布十分均匀。粉体颗粒的累积分布趋势如图2所示。
由上述试验分析可看出, 粉体颗粒中位径为11.17 μ m, 远远小于45 μ m, 颗粒直径到达22.99 μ m时的累积含量就达到了75%。粉体粒径在0.10~31.75 μ m区间时, 随着粉体粒径的增加, 区间含量大体上逐渐增加, 粉体粒径在31.75~72.79 μ m区间, 随着粉体粒径的增大区间含量大幅降低。粉体粒径在0.10~1.05 μ m区间的β -TCP粉体占总量的3.54%, 粉体粒径在1.05~10.50 μ m区间的β -TCP粉体占总量的44.63%, 接近整个含量的一半, 粒径在10.50~26.41 μ m区间的β -TCP粉体占总量的32.18%, 所占比例接近三分之一, 粒径在26.41~72.79 μ m之间的β -TCP粉体占总量的19.65%, 且在26.41~72.79 μ m区间之内, 随着粒径增大, 所占比例减少。同时, 从表1中可以看出在12.63~45.91 μ m区间内每段的粉体含量都在3%以上, 所占比例最大。制得的粉体粒径能够较好地满足制备生物医用陶瓷对粉体颗粒粒度的要求。
| 表1 β -TCP粉体的激光粒度分析 Table 1 β -TCP powder laser particle size analysis |
| 表2 β -TCP粉体的颗粒粒径物理参数 Table 2 Physical parameters of particle size β -TCP powder |
制备仿骨β -TCP多孔生物陶瓷的方法有很多, 包括添加致孔剂法、有机泡沫浸渍法、发泡法等, 每种方法都有各自的优缺点[5, 6], 经综合考虑, 本试验采用添加致孔剂[7]的方法制备多孔仿骨β -TCP生物陶瓷。陶瓷制备的具体工艺流程如图3所示
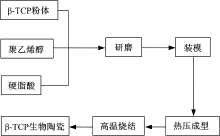 | 图3 制备仿骨β -TCP生物陶瓷工艺流程Fig.3 Preparation of imitation bone β -TCP biological ceramic process flow diagram |
本试验以前期自制的纯净β -TCP粉体为基体, 其中致孔剂和高温粘接剂的选择要保证成分无毒, 对人体无害, 且经高温烧结后也无有害杂质残留。综合考虑各种材料性质后选用硬脂酸(分析纯)作为致孔剂, 硬脂酸为有机物、无毒性, 在加热到360 ℃时完全分解, 留下孔隙结构; 选用在高温条件下具有较好黏和作用的聚乙烯醇(PVA)作为粘结剂。制备的多孔陶瓷试样, 其中选取β -TCP粉体、硬脂酸和聚乙烯醇的质量分数分别为60%, 30%, 10%。将β -TCP粉体颗粒在研钵中研磨得到粒度均匀的粉体, 硬脂酸颗粒研磨后过40目标准筛得到颗粒均匀的致孔剂。通过一定的混合方法将粉体混合均匀后装填入圆柱形模具中, 依据硬脂酸和聚乙烯醇的理化性质在热压机上选取40 ℃的热压温度和适当的成型压力最终得到圆柱状陶瓷胚体, 在马弗炉中以1000 ℃高温烧结, 得到仿骨β -TCP多孔生物陶瓷。
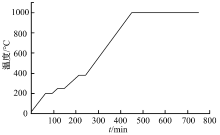
根据硬脂酸以及聚乙烯醇(PVA)的理化特性对烧结温度进行设定, 前期加热速度不宜过快, 在聚乙烯醇的熔融点(200 ℃)附近应保温一定时间, 保证高温粘结剂PVA熔化与粉体充分接触粘结; 硬脂酸分解的温度在380 ℃应保温避免致孔剂分解挥发过快导致陶瓷胚体塌陷。设定的具体情况为, 室温200 ℃, 加热60 min, 保温30 min; 200~250 ℃, 加热25 min, 保温30 min; 250~380 ℃, 加热65 min, 保温30 min; 380~1000 ℃, 升温时间207 min, 保温5 h, 随炉冷却。温度随时间变化情况如图4所示。
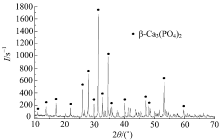
对烧结后的陶瓷试样进行X射线衍射(XRD)分析经PDF卡片库对比证明陶瓷烧结后的主晶相仍为β -TCP, 从图5可以看出主晶相的衍射峰很高且较尖锐、无明显杂质峰存在。所以经过1000 ℃的烧结后, 得到的β -TCP多孔生物陶瓷较纯净, 可满足生物材料制备的基本要求。在烧结过程中添加的致孔剂硬脂酸与粘结剂PVA在高温环境下分解挥发完全, 无任何残留, 高温烧结保证了制备的β -TCP多孔生物陶瓷试样的纯度。
使用德国蔡司的SUPRA-40型场发射扫描电镜对高温烧结的β 相磷酸三钙生物陶瓷的表面形貌和内部孔径结构进行分析。制备的多孔β -TCP生物陶瓷为非金属材料, 不导电, 需要进行喷金处理, 扫描结果SEM图像如图6所示
经过扫描电镜分析β -TCP生物陶瓷样品的表面形貌如图6(a), 看到陶瓷试样表面较致密且存在尺寸不规则的孔洞, 孔洞是致孔剂硬脂酸在高温条件下受热分解挥发产生的, 表面层致密因模压成型时表面层受力较大而中间层受力相对较小所致。内部孔隙结构如图6(b)所示, 在陶瓷试样内部致孔剂硬脂酸在高温环境中分解挥发形成孔隙的效果较好。研究表明:孔径大于10 μ m能使细胞进入孔内, 15~50 μ m可形成纤维组织[8]。图6(b)显示陶瓷内部孔隙尺寸在几微米到几十微米的区间内分布均匀, 且孔隙之间相互连通性很好。适当的孔隙有利于细胞长入后形成组织, 孔隙间相互贯通有利于毛细血管网络的形成、便于营养成分的输送, 更有利于骨骼组织的形成和生长。同时图6(b)中内部孔隙的效果表明陶瓷成型过程中致孔剂与β -TCP粉体混合均匀, 加热温度、升温速度和保温时间的控制较合理, 避免了加热过快使硬脂酸熔化造成陶瓷试样内部β -TCP粉体粘接团聚。生物陶瓷试样外密内疏的结构模仿了胫骨组织外层到内层逐渐由致密骨骼转变到网状疏松骨骼结构, 保证仿骨β -TCP多孔陶瓷材料力学性能的要求。
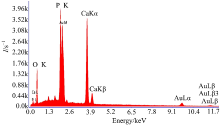
对高温烧结的仿骨β -TCP多孔生物陶瓷材料进行能谱分析, 使用SUPRA-40场发射扫描电镜所配备的X射线能谱仪(EDX)对试样进行成分分析确定元素组成, 对试样部分进行面扫描得到的扫描结果如图7所示。
由图7可以看出仿骨β -TCP生物陶瓷含有O、P、Au以及Ca四种元素, 其中Au是在进行电镜分析试验时为使试样导电而对试样表面进行喷金处理产生的, 并非试样自身含有的元素。根据图中数据可以计算出钙磷的原子比为1.5, 符合β -磷酸三钙的钙磷原子比例, 进一步说明制备试样为仿骨β -TCP生物陶瓷。
选用一种离子浓度与人体血浆的无机成分相近的溶液作为模拟体液(Simulated Body Fluid SBF), 将试样放入模拟人体内生物环境的溶液中通过观察试样的变化来评价β -TCP的生物活性及降解性[9, 10]。本试验配置1.5 SBF(1.5 SBF为SBF的浓度增加到150%)溶液中[11], 配方及药品如表3所示。
| 表3 模拟体液(SBF溶液)配方 Table 3 Simulated body fluid(SBF)formula |
改变致孔剂的添加量15%、20%、25%、30%得到4组陶瓷样品, 其中每组样品取5个, 使用AL204型电子天平对试样进行称重, 结果精确到0.01 g, 按照β -TCP质量与模拟体液体积1 g对应100 ml的比例进行浸泡, 试验在HH-CP-01P型恒温培养箱中进行, 温度设定为与人体体温相近的36.8 ℃, 每隔24 h对SBF溶液进行更换, 每天注意观察变化情况。14天后, 取出一部分样品进行成分分析, 28天后, 再取出一部分样品进行分析。
试验进行到14天, 28天时分别取出每组的5个试样, 在超声波振荡的条件下用去离子水反复清洗后放在2K-35S型电热真空干燥箱中设定60 ℃进行干燥, 干燥24 h后每隔半小时取出称量质量, 直到变化不明显时证明试样完全干燥, 用AL204型电子天平称量其质量精确到0.01 g, 并与降解前的质量进行对比, 从而得到降解率[9]。
降解率=
通过计算公式得到平均降解率, 其数据如表4所示。
| 表4 降解14天和28天后的降解率 Table 4 14 and 28 days, the degradation rate of degradation |
由上表可以看出, 4组试样降解情况良好, 前14天降解率都在3%以上, 其中最高的第4组达到了5.86%, 降解率较高, 这应该与第4组陶瓷的致孔剂添加量30%与其他三组相比较高有关, 较多的致孔剂在烧结过程中形成的孔隙更多, 在降解过程中陶瓷与SBF溶液的接触面积大, 导致降解速率更快。从表4可以看到在降解28天以后, 4个组的陶瓷样品降解率都增加一倍左右, 降解稳定性良好, 随着时间的增长降解速率没有发生突变, 试样的降解性能稳定。
对上述降解性能较好的第4组样品进行扫描电镜观察分析结果如图8所示, 降解14天后的生物陶瓷的扫描电镜图片显示多孔β -TCP生物陶瓷在SBF溶液降解均匀, 与降解前相比表面有颗粒状新物质生成, 生物陶瓷表面被一层新生颗粒状物质均匀覆盖。由于陶瓷表面的β -TCP良好的生物相容性, 溶液中的钙磷离子逐渐沉积在β -TCP表层后形核生长, 研究表明[12]表面新生成的物质是类骨羟基磷灰石。
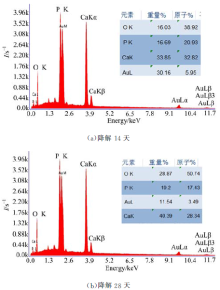
对仿骨β -TCP生物陶瓷第4组试样降解后的表面进行能谱分析, 并分别对降解14天和降解28天的样品进行检测, 结果如图9所示。
从图9(a)中可看出, 降解14天以后, 钙磷两种元素原子比例由降解前的1.5上升至1.57, 钙磷元素原子比的增大, 证明降解过程中在生物陶瓷的表面产生了钙磷层物质, 经XRD分析为类骨羟基磷灰石物质。羟基磷灰石是形成骨骼的主要成分, 因此可以判断在生物陶瓷降解的同时表面也有类羟基磷灰石物质的形成, 体现了β -TCP陶瓷的生物活性。从图9(b)中可以看到降解28天以后, 钙磷元素原子比例进一步上升达到1.63, 更加接近羟基磷灰石的钙磷原子比1.67, 说明随着生物陶瓷降解时间的增长, 表面产生的类羟基磷灰石物质逐渐增加层叠, 其成分更加接近骨骼。EDX能谱分析与SEM分析观测得到的结果一致, 表明了多孔β -TCP生物陶瓷在降解过程中表层生成类骨羟基磷灰石物质。
本研究提出以一种新的物质2-膦酸丁烷-1, 2, 4-三羧酸作为磷源在凝胶反应合成前驱体的基础上高温烧结得到较传统液相合成方法更加纯净的微米级β 相磷酸三钙粉体, 采用致孔剂法通过模压成型高温烧结得到β -TCP多孔生物陶瓷。陶瓷内部孔隙尺寸在几微米到几十微米范围内均匀分布, 满足细胞长入陶瓷内部的条件, 孔隙间相互贯通, 可使毛细血管网络形成, 利于营养物质输送。在模拟体液SBF溶液中的降解试验表明, 多孔生物陶瓷表面有类骨羟基磷灰石物质生成。随着生物医学材料的进一步发展, β 相磷酸三钙基生物陶瓷材料的用途和各项性能将受到更大的关注。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|