作者简介:马军彦(1983-),男,博士研究生.研究方向:柴油机排放控制.E-mail:junyanm@163.com
通过理论分析、热重实验、平衡压实验,对比了碳酸氢铵、碳酸铵、氨基甲酸铵3种铵盐的氨含量、分解温度、分解速率等特性。得出以下结论:氨基甲酸铵的氨含量最高,碳酸铵次之,碳酸氢铵最小;氨基甲酸铵和碳酸铵在室温下就开始分解,碳酸氢铵加热到100 ℃时只分解了5.6%;氨基甲酸铵在低于90 ℃时比碳酸铵分解速率快,在相同时间和温度下,氨基甲酸铵能产生更多的氨气;碳酸铵和氨基甲酸铵的分解平衡压相当,两者都是SCR系统还原剂的优良来源,氨基甲酸铵优势更明显。
The ammonia content, decomposition temperature and decomposition rate of ammonium bicarbonate, ammonium carbonate and ammonium carbamate are investigated by theoretical analysis, Thermogravimetric Analysis (TGA) experiment and equilibrium pressure experiments. Results show that ammonium carbamate has the highest ammonia content, followed by ammonium carbonate, and ammonium bicarbonate has the lowest ammonia content. Ammonium carbonate and ammonium carbamate can decompose from room temperature, but when heated to 100 ℃ ammonium bicarbonate only decomposes 5.6%. When the temperature is below 90 ℃, the decomposition rate of ammonium carbamate is higher than that of ammonium carbonate. Under the same period and same temperature, ammonium carbamate produces more ammonia. The decomposition equilibrium pressures of ammonium carbonate and ammonium carbamate are similar; both are excellent candidates of reductant of Selective Catalytic Reduction (SCR) system, but ammonium carbamate has more obvious advantages.
随着排放法规的升级以及对环境保护的热切要求, 控制车辆NOx排放变得越来越严苛。目前我国主要使用SCR技术来降低柴油机的NOx排放。SCR技术采用32.5%的尿素水溶液作为还原剂, 商品名称为“ 添蓝” , 但是尿素水溶液作为还原剂目前还存在几个无法解决的问题[1, 2, 3]:低温结冰, 尿素水溶液的冰点为-11 ℃, 在寒冷的北方, 冬季必须采取保温和化冰的措施, 否则无法使用; 尿素水溶液热解水解产生NH3的最低温度为200 ℃, 一些研究采用低温下不喷尿素水溶液的策略[4], 在低速空载或低负荷时, 柴油机的排温只有150 ℃或者更低, 并且随着发动机热效率的提高, 排温会持续下降[5, 6]。研究发现, 330 ℃时只有20%的尿素可以发生热解, 而400 ℃时有50%的尿素可以发生热解[7], 不仅NOx的转化效率降低, 未分解的尿素水溶液随尾气排放到大气中还会造成二次污染。另外, 更高的排放法规也要求必须提高NOx在低温时的转化效率[8]。从产生氨气的源头出发, 解决上述问题的方法之一就是使用固态还原剂来产生氨气[9, 10], 通过加热使固态还原剂分解来产生氨气, 固态还原剂的受热分解相对于尿素水溶液的最大优点是可以不受排气温度的限制。碳酸氢铵、碳酸铵、氨基甲酸铵3种铵盐受热分解都有氨气产生, 碳酸氢铵、碳酸铵是常用的化肥, 氨基甲酸铵是工业制尿素的中间产物, 这3种铵盐在我国产量大、价格便宜, 是固态还原剂的合适备选材料。
本文以碳酸氢铵、碳酸铵、氨基甲酸铵为主要研究对象, 利用热重分析(TGA)实验和平衡压实验, 对上述3种铵盐的热分解进行了研究。给出了3种铵盐的含氨量、氨气释放能力和氨气释放温度。
加热能产生氨气的固体物质有很多, 但是应用到车用SCR系统, 需要考虑几个条件:①原料产量充足; ②价格相对低廉; ③受热分解后产生的气体除氨气外无其他有害气体或者是发动机排放的气体成分之一; ④单位质量的氨含量比尿素水溶液高。综合以上考虑, 碳酸氢铵、碳酸铵、氨基甲酸铵是符合以上条件的备选铵盐。其受热分解反应方程式如下:
碳酸氢铵热分解方程式:
碳酸铵热分解方程式:
氨基甲酸铵热分解方程式:
尿素水溶液热分解方程式:
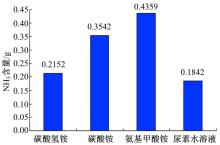
1 g上述4种氨源的含氨量如图1所示。由上述分解方程可知1 mol的尿素可以分解出2 mol的氨, 但是车用标准尿素水溶液所含尿素质量分数为32.5%, 所以1 g尿素水溶液只含有0.1842 g的氨, 是4种氨源中单位质量含氨量最小的。单位质量氨基甲酸铵的氨含量最高, 达到0.4359 g, 是尿素水溶液的2.37倍, 是碳酸氢铵的2.03倍; 碳酸铵次之, 为0.3542 g, 是尿素水溶液的1.92倍, 碳酸氢铵的1.65倍; 碳酸氢铵的氨含量是尿素水溶液的1.17倍。
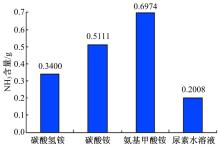
图2为1 ml四种氨源的含氨量。在相同体积下, 氨基甲酸铵完全分解所释放出的氨最多, 为0.6974 g, 其次是碳酸铵、碳酸氢铵、尿素水溶液。
氨基甲酸铵能够释放的氨是尿素水溶液的3.47倍, 是碳酸氢铵的2.05倍, 是碳酸铵的1.36倍; 碳酸铵能释放的氨是尿素水溶液的2.55倍, 是碳酸氢铵的1.5倍; 碳酸氢铵能释放的氨是尿素水溶液的1.69倍。
通过以上理论分析, 对比了这4种氨源单位质量和体积的含氨量。在质量或体积相同时, 氨基甲酸铵含氨量是4种氨源中最高的, 碳酸铵其次, 比尿素水溶液的氨含量有很大优势。相同条件下, 3种固态铵盐的含氨量都比尿素水溶液高, 如果应用到SCR系统中, 可以延长添加还原剂的周期。但是尿素水溶液作为柴油机SCR系统还原剂的应用已经很成熟, 上述3种铵盐的分解条件需进一步研究, 以确定相对于尿素水溶液分解的难易程度。
热重分析(TGA)是通过自动控制温度, 测量物质质量与温度变化关系的方法, 可以确定被测试样的热稳定性、分解温度、分解速率等[11]。热重分析仪主要由加热炉、温度程序控制系统、温度传感器、记录天平、记录仪、天平控制器等组成, 实验采用美国TA仪器公司的Q500型热重分析仪。通过TGA实验, 考查了纯碳酸氢铵、碳酸铵、氨基甲酸铵3种铵盐的分解过程。
将一定量的试样放入仪器中, 使用3个不同的升温速率加热试样到完全分解, 研究了3种铵盐的反应起始温度、反应终止温度和分解速率。各个升温过程中试样质量如表1所示, 升温速率分别为5、15、20 ℃/min。
| 表1 各个升温速率下试样的质量(mg) Table 1 Mass of samples at different heating rates(mg) |
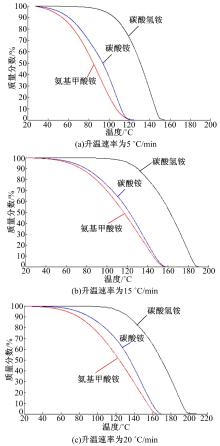
图3(a)为升温速率5 ℃/min时3种铵盐的热重分析曲线。3种铵盐的分解曲线很平滑, 没有台阶, 说明从开始受热到完全分解是连续完成的, 没有中间产物生成。碳酸铵和氨基甲酸铵从室温开始就可以分解, 且完全分解温度都在120 ℃左右。但在相同的温度下, 氨基甲酸铵的分解速率更高; 碳酸氢铵的起始分解温度大约为80 ℃, 此温度下, 碳酸氢铵只分解了1%, 而氨基甲酸铵在80 ℃时分解了42%, 碳酸铵分解了30%。碳酸氢铵在80 ℃以下分解速率相对另两种铵盐非常缓慢, 超过100 ℃后才开始迅速分解, 150 ℃左右完全分解。通过理论计算, 纯碳酸氢铵的起始分解温度为86 ℃[12], 与实验结论基本一致。
三种铵盐材料中, 碳酸氢铵的起始分解温度和完全分解温度最高, 在100 ℃以下分解最缓慢。相同条件下, 氨基甲酸铵和碳酸铵比碳酸氢铵更容易分解, 而且产生的氨气量比碳酸氢铵多。氨基甲酸铵和碳酸铵分解温度、氨含量、体积都相差不多, 较低温度下就能快速分解, 比碳酸氢铵分解所耗费的能量更少。
图3(b)(c)分别为升温速率15 ℃/min和20 ℃/min时3种铵盐的分解曲线。由这两个升温速率的热重分析曲线可知, 升温速率的升高使得氨基甲酸铵和碳酸铵的起始分解温度提高了大约10 ℃, 碳酸氢铵的起始分解温度提高到100 ℃左右。15 ℃/min升温时, 氨基甲酸铵和碳酸铵的完全分解温度提高到155 ℃左右, 两者的分解过程、分解速率比较接近; 碳酸氢铵的完全分解温度提高到188 ℃左右。20 ℃/min升温时, 氨基甲酸铵、碳酸铵和碳酸氢铵的完全分解温度分别提高到163 ℃、168 ℃和200 ℃左右。碳酸铵和氨基甲酸铵分解曲线比较接近, 都比碳酸氢铵分解速率快。在3个升温速率下, 3种铵盐都是连续分解完成, 没有中间产物生成, 碳酸铵和氨基甲酸铵从室温就可以分解, 碳酸氢铵的完全分解温度始终最高。升温速率越大, 所产生的热滞后越严重, 使得3种铵盐的起始分解温度和完全分解温度增大。
恒温热重分析能够体现试样在指定温度下的分解速率, 将一定量的试样从室温开始加热, 到达指定温度后维持温度恒定一段时间, 以考查试样在不同恒定温度下的分解特性。试样质量如表2所示。
| 表2 恒定温度下试样的质量(mg) Table 2 Mass of samples at different constant temperatures(mg) |
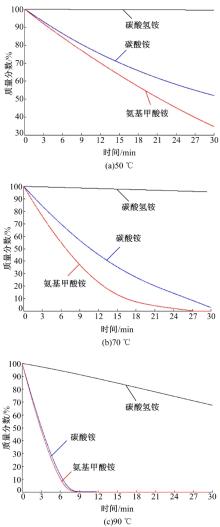
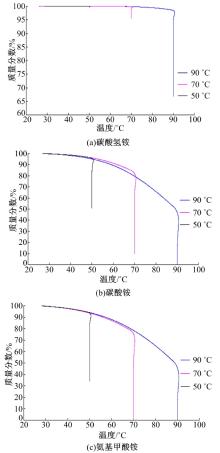
图4(a)(b)(c)分别是碳酸氢铵、碳酸铵和氨基甲酸铵从室温开始, 以5 ℃/min的速率加热, 直至达到50、70、90 ℃时维持30 min的质量变化曲线。在整个升温和恒温加热时间内, 碳酸氢铵在50 ℃下几乎没有分解, 整个受热过程结束时只分解了0.44%, 70 ℃受热结束时分解了4.56%, 在90 ℃下分解速率明显加快, 最终分解了33.27%。碳酸铵在50 ℃和70 ℃结束时分解了49.67%和90.46%, 90 ℃受热时能够完全分解。氨基甲酸铵在50 ℃受热结束时分解了66.45%, 70 ℃和90 ℃受热结束时都能完全分解。在50 ℃和70 ℃的整个加热过程中, 氨基甲酸铵分解的最多, 分解速率最快。90 ℃下碳酸铵和氨基甲酸铵都能完全分解。由于热惯性, 当到达指定的温度时都会有短暂的温度继续上升, 但不影响实验整体过程。
 | 图4 三种铵盐在三个指定升温过程中的分解Fig.4 Decomposition of three kinds of ammonium salt during three designated temperature |
图5(a)(b)(c)分别为碳酸氢铵、碳酸铵和氨基甲酸铵在50、70和90 ℃恒温下30 min的分解过程。在三个恒温受热过程中, 碳酸氢铵在50 ℃下基本没有分解, 在70 ℃恒温下经过30 min分解了4%, 90 ℃恒温下分解了32.46%。碳酸铵在50 ℃恒温下分解了47.96%, 在70 ℃恒温下分解了97.09%, 接近完全分解, 90 ℃恒温下完全分解。氨基甲酸铵在50 ℃恒温下分解了65.18%, 在70 ℃和90 ℃恒温下都能完全分解。在3个恒定温度下, 碳酸氢铵的分解程度最小, 氨基甲酸铵的分解程度最高, 速率最快。在90 ℃下碳酸铵和氨基甲酸铵分解速率很接近。
热重分析主要受实验条件、仪器因素和试样的影响[10]。其中以试样的影响最为复杂, 试样的吸热会引起试样温度发生偏差, 这种偏差随试样用量的增大而增大。根据仪器特点及经验, 本文在热重分析中试样的取量为10~20 mg是合理的。试样粒度对热传导、气体扩散有较大影响, 粒度越小, 反应速率越小, 起始分解温度和完全分解温度越低。通过以上实验分析, 三种铵盐中, 碳酸氢铵的热稳定性最好, 在较低温度下难以分解, 分解耗费的能量最高。而碳酸铵和氨基甲酸铵的分解能力较高, 在较低温度下就能快速、大量地分解, 是比较合适的SCR系统氨源。
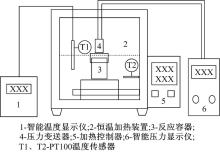
碳酸铵和氨基甲酸铵的受热分解都是可逆的, 每一个温度都对应一个平衡压力, 即在温度不变时, 正逆反应会在达到某一压力时平衡, 反应在密闭容器中进行时, 压力会维持恒定, 或者气体流出反应容器速率与气体生产速率相同时, 容器能维持一定的压力。通过自制的实验装置研究了碳酸铵和氨基甲酸铵在密闭容器中的平衡压力。装置如图6所示, 主要包括水浴锅、反应容器、压力变送器等。水浴锅内温度误差为± 0.5 ℃。
反应容器外壳是不锈钢材质, 底部有圆孔与热水浴相通, 容器内部装有聚四氟乙烯内衬, 将铵盐放入内衬, 通过容器上盖压紧, 使内衬的底面与容器底部圆孔紧密贴合, 既保证容器的密封性又加强了热水对内衬的加热。容器上盖连接压力变送器, 智能压力显示仪显示当前压力。当水浴锅内的温度达到设定温度后, 稳定5 min使得反应容器内、外温度一致, 容器中的反应达到平衡再读取压力显示仪示数, 水浴锅能达到的最高温度为100 ℃。
对于氨基甲酸铵分解平衡压力的实验研究较多, 文献[13]给出了氨基甲酸铵分解平衡压力的经验公式:
图7为实验值与理论计算值的对比, 由图可知实验值与经验公式计算值基本一致, 说明实验所用装置及方法是正确可行的。
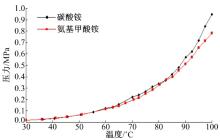
图8为碳酸铵和氨基甲酸铵的分解平衡压力对比, 温度越高, 分解平衡压力越大; 两种铵盐在大约85 ℃以下时的平衡压力基本相当; 在90~100 ℃时, 碳酸铵的分解平衡压力超过氨基甲酸铵比较明显, 在100 ℃时达到最大值0.947 MPa, 氨基甲酸铵为0.782 MPa。两种铵盐在85 ℃之后的平衡压力基本上超过了现有尿素SCR系统的喷射压力, 并且两种铵盐直接产生气体。两种铵盐的平衡压力曲线较平滑, 与上述的热重分析相对应, 同样说明碳酸铵和氨基甲酸铵受热分解过程中没有中间产物的生成。
 | 图8 碳酸铵和氨基甲酸铵的分解平衡压力Fig.8 Decomposition equilibrium pressure of ammonium carbonate and ammonium carbamate |
由式(2)和(3)可知, 1 mol的碳酸铵完全分解能释放4 mol的气体(水认为是以气态存在), 其中包含2 mol的氨气; 1 mol的氨基甲酸铵完全分解能释放3 mol的气体, 也包含2 mol的氨气。所以在相同温度下, 碳酸铵完全分解出的气体比氨基甲酸铵多, 其产生的压力大。在温度较低时两者相差无几, 可能是由于水凝结成液态所致。随着温度升高, 水滴转化成水蒸气, 使压力增大。通过上述实验可知碳酸铵和氨基甲酸铵在密闭容器中受热分解都能产生较高的压力, 碳酸铵由于分解会产生较多水而在较高温度下会比氨基甲酸铵分解产生的压力高。但是水蒸气如果进入管道有可能在管壁凝结, 从而降低管壁以及管道内温度, 那么氨基甲酸铵的优势就比碳酸铵更明显。
(1)相同质量或者体积的上述4种还原剂, 氨基甲酸铵的氨含量最高, 碳酸铵次之, 碳酸氢铵第三, 尿素水溶液最小。
(2)碳酸铵、碳酸氢铵、氨基甲酸铵受热分解都没有中间产物, 相同条件下碳酸氢铵的起始分解温度最高, 分解能力最低, 完全分解所耗费的能量最多。碳酸铵与氨基甲酸铵在室温就可以分解, 两者的分解过程类似, 反应区间相当。
(3)在较低温度下, 氨基甲酸铵的分解速率比碳酸铵快, 产生氨气的能力更强。
(4)碳酸铵和氨基甲酸铵在密闭容器中受热时产生的压力相当, 在较高温度下, 碳酸铵分解产生的压力更高。碳酸铵和氨基甲酸铵都是SCR系统的优质氨源, 在较低温度下, 氨基甲酸铵更具优势。可以作为现有尿素SCR系统尿素水溶液的补充, 提高低温下SCR系统的转化效率。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|