作者简介:王雪松( 1978-) ,女,讲师,博士研究生.研究方向:次生代谢产物调控.E-mail:xuesong@jlu.edu.cn
利用RT-PCR技术和酶切连接技术克隆得到人参皂苷生物合成关键酶DS和D12H基因,并构建出两种基因的表达载体DS-pAUR123和D12H-pAUR123。通过热转化法将两个表达载体转化到酿酒酵母中,得到重组工程菌。两种基因在重组工程菌中能够表达出具有催化功能的活性蛋白质,实现了人参DS和D12H基因的异源共表达。
DS and D12H genes, which are involved in ginsenoside biosynthesis were obtained by Reverse Transcription Polymerase Chain Reaction (RT-PCR) and Enzyme Digestion Connection (EDC) techniques. Expression vectors of both genes were constructed, namely DS-pAUR123 and D12H-pAUR123. Then, both expression vectors were transformed into Saccharomyces cerevisiae. Results show that both genes can be heterologously expressed into functional enzymes.
人参皂苷是人参的主要活性成分, 具有多种药理效用[1]。研究表明, 人参中人参皂苷生物合成的前体是2, 3-氧化角鲨烯, 2, 3-氧化角鲨烯在关键酶达玛烯二醇合成酶(Dammarenediol synthase, DS)作用下生成达玛烯二醇, 达玛烯二醇在原人参二醇合成酶(也称达玛烯二醇-12-羟化酶, Dammarenediol 12-Hydroxylase, D12H)作用下生成原人参二醇, 原人参二醇进一步羟基化或糖基化形成多种人参单体皂苷[2, 3]。在真核生物酿酒酵母中存在2, 3-氧化角鲨烯的生物合成途径, 而且酿酒酵母生长快、安全性高[4], 是理想的人参皂苷合成相关酶基因的异源表达宿主。本研究利用RT-PCR技术从人参发根中克隆出人参皂苷生物合成关键酶DS和D12H基因, 并通过酶切连接技术构建出两种基因的表达载体, 转化到酿酒酵母中, 获得表达两种关键酶并产生原人参二醇的重组工程酵母, 实现了DS和D12H的异源共表达, 为人参皂苷体外合成研究奠定了基础。
人参发根为本实验室保存。感受态大肠杆菌JM109、鲑鱼精DNA、琼脂糖、青霉素购于北京鼎国生物制品有限公司。酿酒酵母(CICC, 31476)购自中国工业微生物菌种保藏管理中心。酿酒酵母表达载体pAUR-123、RNA提取试剂盒、反转录试剂盒、DNA凝胶回收试剂盒、pMD18-T载体试剂盒、T4DNA连接酶试剂盒、DNA聚合酶、限制性内切酶、dNTP、抗生素Aureobasidin A(AbA)、DNA Marker等购于宝生物工程(大连)有限公司。原人参二醇标准品购于吉林大学医学部, 其余试剂为国产分析纯。
1.2.1 人参发根中DS和D12H基因的克隆
以MS液体培养基培养21天的人参发根为试验材料, 使用RNA提取试剂盒提取人参发根总RNA, 使用反转录试剂盒RT-PCR合成cDNA。根据GenBank中报道的人参DS和D12H基因, 使用软件Primer Premier 5.0分别设计含有SmaⅠ 酶切位点的上游引物和含有SacⅠ 酶切位点的下游引物:
DS-F, 5'-CCCGGGATGTGGAAGCAGAAGGGT-3'
DS-R, 5'-GAGCTCTTAAATTTTGAGCTGCTGGTG-3'
D12H-F, 5'-CCCGGGATGGCAGCAGCAATGGTGTT-3'
D12H-R, 5'-GAGCTCGTGGG GATGTAGATGAATGGGA-3'
以cDNA为模板, 扩增DS基因的PCR程序为:预变性:94 ℃, 5 min; 5个循环{94 ℃, 40 s; 63 ℃, 1 min; 72 ℃, 2 min}(退火温度每循环1次降低1 ℃); 30个循环{94 ℃, 45 s; 58 ℃, 50 s; 72 ℃, 3 min}; 72 ℃, 8 min; 4 ℃保存。扩增D12H基因的PCR程序为:预变性:94 ℃, 5 min; 5个循环{94 ℃, 40 s; 70 ℃, 40 s; 72 ℃, 2 min}(退火温度每循环1次降低1 ℃); 30个循环{94 ℃, 45 s; 65 ℃, 65 s; 72 ℃, 2 min}; 72 ℃, 10 min; 4 ℃保存。
1.2.2 DS和D12H基因的纯化
使用DNA凝胶回收试剂盒对DS和D12H基因PCR扩增产物进行基因片段回收纯化, 纯化后的DS和D12H基因片段分别与pMD18-T载体连接, 连接产物热转化至感受态大肠杆菌JM109细胞。转化后的细胞均匀涂布在含有氨苄青霉素的LB固体培养基中, 37℃过夜培养, 形成单菌落。对于转化结果进行菌落PCR鉴定和提取质粒酶切鉴定后, 筛选出的带有克隆载体DS-pMD18-T和D12H-pMD18-T菌株进行测序验证。
1.2.3 DS和D12H基因表达载体的构建及转化
使用限制酶SmaⅠ 和SacⅠ 对切胶回收的目的DS和D12H基因片段及pAUR123表达载体同时进行双酶切; 酶切后的DS和D12H基因片段在T4 DNA连接酶作用下分别与酶切后的pAUR123表达载体连接; 连接产物转入感受态大肠杆菌JM109细胞, 提取阳性克隆菌质粒进行酶切鉴定, 筛选出带有重组表达载体DS-pAUR123和D12H-pAUR123的菌株。
制备酿酒酵母感受态细胞, 采用LiAc/SS-DNA/PEG转化方法[5]将重组质粒DS-pAUR123和D12H-pAUR123依次转入后, 涂布于含抗生素AbA的YPD固体培养基, 30 ℃培养2~4天。重组酿酒酵母菌提取质粒, 酶切鉴定。
1.2.4 DS和D12H基因在酿酒酵母中的鉴定
重组酿酒酵母菌在YPD液体培养基中于30 ℃、160 r/min条件下振荡培养36 h, 提取酵母蛋白[6], SDS-PAGE蛋白电泳分析鉴定DS和D12H基因表达产物达玛烯二醇合成酶和原人参二醇合成酶。
1.2.5 酿酒酵母工程菌中原人参二醇的检测
用色谱级甲醇溶解原人参二醇标准品, 配制不同质量分数的标准品溶液, 采用高效液相色谱法(HPLC)进行质量分数测定, 以原人参二醇标准品质量分数为纵坐标, 峰面积为横坐标绘制标准曲线。酿酒酵母工程菌在YPD液体培养基中于30 ℃、160 r/min条件下振荡培养36 h, 提取原人参二醇, HPLC法测定酵母细胞提取样品中的原人参二醇含量。
提取人参发根总RNA, 质量分数为1%的琼脂糖凝胶电泳鉴定。电泳结果如图1所示, 可以看出28 S、18 S和5 S rRNA 3条明显特征条带, 且28S rRNA与18S rRNA亮度和宽度比大约为2∶ 1, 因此所提取的总RNA比较完整, 质量较好, 适合反转录cDNA。
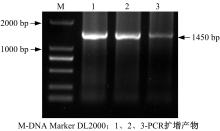
以cDNA为模板, 以DS-F、DS-R和D12H-F、D12H-R为引物, PCR扩增DS和D12H基因, PCR产物电泳结果如图2和图3所示。
图2中在约2300 bp处有清晰条带, 与已发表的人参DS基因长度相符[7]; 图3中在约1450 bp处有清晰条带, 与已发表的人参D12H基因长度相符[8]。
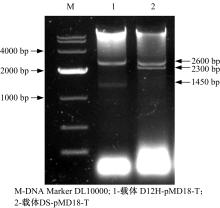
纯化后DS和D12H基因片段分别与pMD18-T载体连接, 转化大肠杆菌JM109细胞后, 提取阳性克隆菌载体DS-pMD18-T和D12H-pMD18-T双酶切鉴定, 电泳结果如图4所示。
图4中1泳道2600 bp和1450 bp条带分别是pMD18-T载体和D12H基因; 2泳道2600 bp和2300 bp条带分别是pMD18-T载体和DS基因, 酶切鉴定分析确定两种基因的克隆载体构建成功。阳性克隆菌送交大连宝生物公司测序, 并将测序结果与GenBank中的已发表的人参DS和D12H基因进行对比, 结果表明:DS基因的相似度为99.68%, 有8个碱基不同; D12H基因相似度为99.66%, 有5个碱基不同。克隆的两种基因都与已发表的基因具有极高的相似度, 确定成功克隆了本实验室的人参发根的DS和D12H基因, 可用于后续实验。
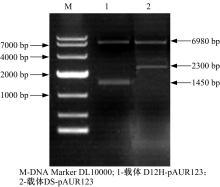
酶切连接构建的表达载体DS-pAUR123和D12H-pAUR123, 转化大肠杆菌JM109细胞后, 提取质粒双酶切鉴定, 电泳结果如图5所示。1泳道6980 bp和1450 bp条带是双酶切后的pAUR123和D12H基因; 2泳道6980 bp和2300 bp条带是双酶切后的pAUR123和DS基因, 说明成功构建了DS和D12H基因的表达载体。
表达载体DS-pAUR123和D12H-pAUR123, 依次转化至酿酒酵母细胞中, 构建重组酿酒酵母工程菌Yeast-DS-D12H-pAUR123, 提取质粒双酶切鉴定, 电泳结果如图6所示。
图6中1、2泳道上都有三条条带, 分别是质粒pAUR123、DS基因和D12H基因, 结果说明两种基因都成功化转化至酿酒酵母中。
从培养36 h的酿酒酵母工程菌中提取蛋白, SDS-PAGE结果如图7所示。1泳道是野生型酵母提取的蛋白, 做为对照; 2泳道是只转入DS基因的酿酒酵母菌; 3和4泳道是转入DS和D12H基因的酿酒酵母菌。2、3、4泳道在85.5 kDa左右的位置有达玛烯二醇合成酶的特征条带, 说明DS基因在酿酒酵母工程菌中成功表达, 条带颜色较浅说明表达的达玛烯二醇合成酶的含量比较低。3、4泳道在55.4 kDa左右的位置有原人参二醇合成酶的特征条带, 说明在本实验构建的酿酒酵母工程菌中DS基因和D12H基因能够正常表达。
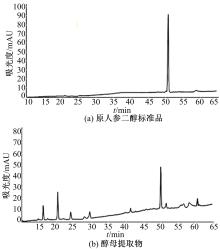
从培养36 h的酿酒酵母工程菌细胞中提取原人参二醇, 取10 μ L提取物样品进行HPLC检测, 得到的图谱如图8所示。提取物样品与原人参二醇标准品的时间均在50 min左右, 其峰面积为113 385 mAu· min。通过原人参二醇标准曲线的回归方程计算出样品的原人参二醇质量浓度为0.0326 mg/mL。酿酒酵母工程菌细胞中检测出原人参二醇, 说明转入的DS和D12H基因表达出有活性的达玛烯二醇合成酶和原人参二醇合成酶, 能够催化2, 3-氧化角鲨烯合成原人参二醇。
使用RT-PCR技术和酶切连接技术克隆得到人参皂苷生物合成关键酶DS和D12H基因, 转化酿酒酵母, 获得了可表达两种基因并生成原人参二醇的酿酒酵母工程菌。本研究实现了人参DS和D12H基因的异源共表达, 构建了酵母细胞中人参皂苷前体原人参二醇的生物合成途径, 为下一步研究酵母细胞合成人参皂苷奠定了基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|