吉林大学学报(医学版) ›› 2022, Vol. 48 ›› Issue (4): 954-961.doi: 10.13481/j.1671-587X.20220415
载TGF-β3甲基丙烯酰化肝素对牙髓干细胞成骨分化能力的影响及其机制
邹馨颖,高爽,赵红,刘新,赵远航,宋嘉卓,闫琳琳,张志民( )
)
- 吉林大学口腔医院牙体牙髓科,吉林 长春 130021
Effect of TGF-β3-loaded methacrylated heparin on osteogenic differentiation of dental pulp stem cells and its mechanism
Xinying ZOU,Shuang GAO,Hong ZHAO,Xin LIU,Yuanhang ZHAO,Jiazhuo SONG,Linlin YAN,Zhimin ZHANG( )
)
- Department of Endodontics,Stomatology Hospital,Jilin University,Changchun 130021,China
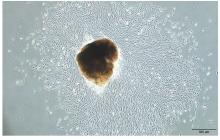
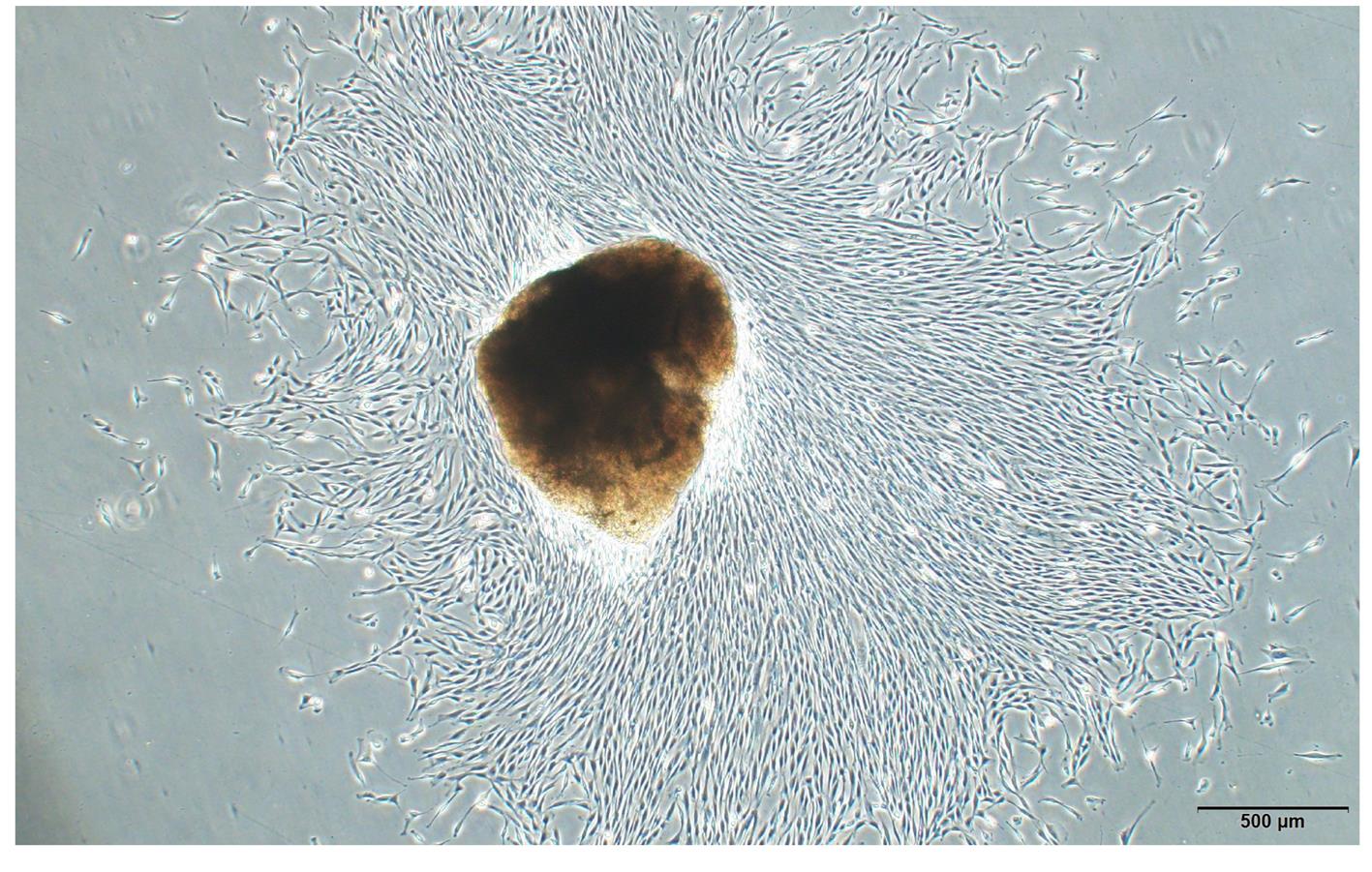
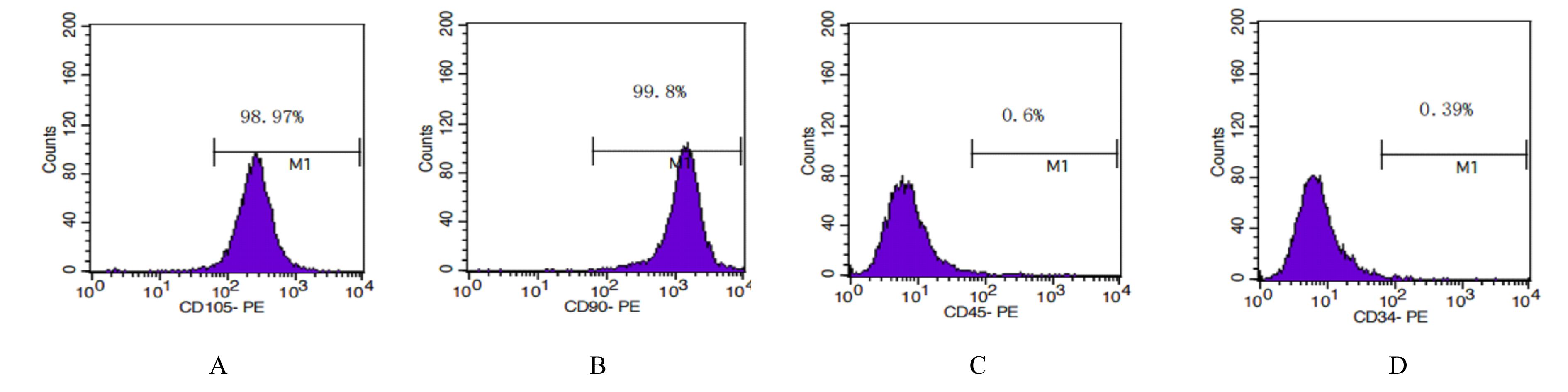
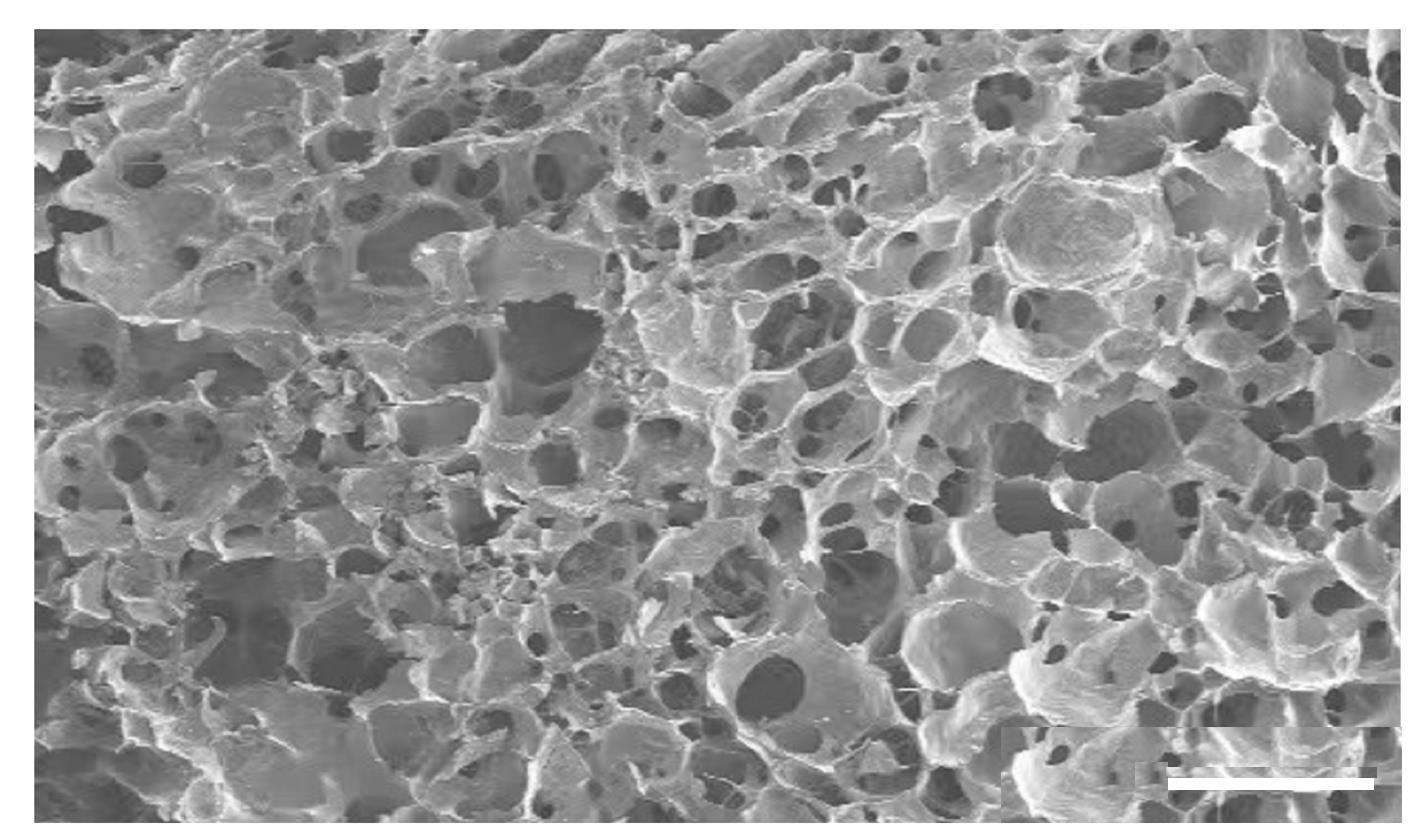
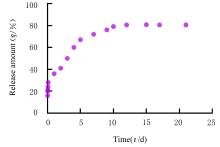
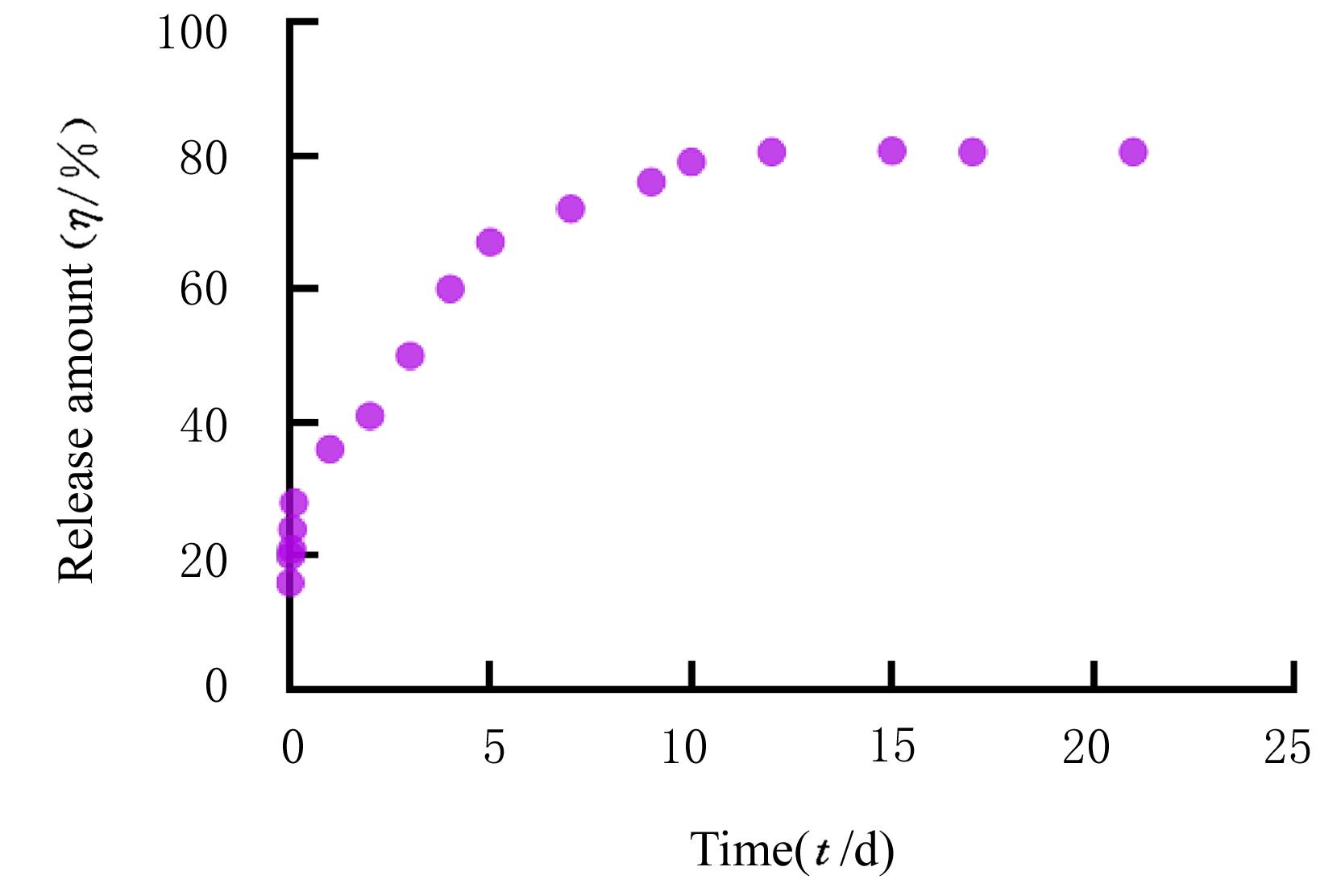
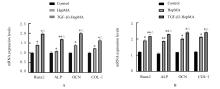
摘要: 探讨载转化生长因子β3(TGF-β3)甲基丙烯酰化肝素(HepMA)对牙髓干细胞(DPSCs)成骨分化能力的促进作用,阐明其可能的作用机制。 体外分离培养人牙髓干细胞(hDPSCs)并通过流式细胞术进行细胞鉴定。合成光固化HepMA水凝胶,利用扫描电子显微镜观察材料表面形态特征。合成载不同浓度(20、40、60、80和100 μg?L-1)TGF-β3的HepMA(TGF-β3-HepMA),采用其浸提液分别培养hDPSCs 1、3和5 d,同时设对照组,采用 CCK-8 法筛选出载TGF-β3的最适浓度。采用酶联免疫吸附测定(ELISA)法检测各时间点TGF-β3-HepMA中TGF-β3的累积释放量并绘制药物释放曲线。hDPSCs分为对照组、HepMA组和载最适浓度TGF-β3的 HepMA(TGF-β3-HepMA)组,加入含有相对应浸提液的培养基培养24 h,配制成骨诱导液分别诱导hDPSCs 7、14和21 d,采用碱性磷酸酶(ALP)染色和茜素红染色法检测各组细胞ALP染色及钙结节形成情况,实时荧光定量PCR(RT-qPCR)法检测各组细胞中成骨相关因子mRNA表达水平。 分离培养的hDPSCs在光学显微镜下观察呈长梭形;流式细胞术检测,培养的hDPSCs中 CD105和CD90呈阳性表达,CD34和CD45呈阴性表达,验证本研究中分离培养的细胞为hDPSCs。扫描电子显微镜(SEM)观察,HepMA平均孔径为50~70 μm。ELISA法检测,TGF-β3在7 d内呈突释阶段后缓慢释放,21 d左右达到平衡。CCK-8法检测,与0 μg?L-1 TGF-β3-HepMA组比较,20、40和60 μg?L-1 TGF-β3-HepMA组hDPSCs增殖率呈剂量依赖性升高(P<0.05),故载TGF-β3的最适浓度为60 μg?L-1。成骨诱导7和14 d时,与对照组和HepMA组比较,TGF-β3-HepMA组细胞中ALP染色面积最大且染色颜色最深,14 d时细胞中ALP染色较7 d时更加明显;成骨诱导21 d时,与对照组和HepMA组比较,TGF-β3-HepMA组细胞中茜素红染色的矿化钙结节面积最大。RT-qPCR法检测,培养7和14 d时,与对照组比较,HepMA组和TGF-β3-HepMA组细胞中Runt相关转录因子2(Runx2)、ALP、骨钙桥素(OCN)和Ⅰ型胶原蛋白(COL-Ⅰ) mRNA表达水平明显升高(P<0.05或P<0.01);与HepMA组比较,TGF-β3-HepMA组细胞中 Runx2、ALP、OCN和COL-Ⅰ mRNA表达水平明显升高(P<0.05)。 载TGF-β3的HepMA能够提高hDPSCs成骨分化能力,其机制可能与上调成骨相关因子的表达有关。
中图分类号:
- R782